Ang unang galvanic cell sa mundo ay binuo ni Luigi Galvani. Basahin ang tungkol sa kasaysayan nito. sa artikulong itoSa esensya, ito ay isang pansamantalang pinagmumulan ng kuryenteng nalilikha ng isang reaksiyong kemikal. Ang daloy ng mga electron ay nalilikha ng interaksyon sa pagitan ng dalawang magkaibang metal. Bilang resulta, ang enerhiyang kemikal ay nababago sa enerhiyang elektrikal, na maaaring magamit sa pang-araw-araw na buhay.
Ang isang concentration galvanic cell ay isang pinagmumulan ng kuryente na binubuo ng dalawang magkaparehong metal electrodes na nakalagay sa pinaghalong mga asin ng metal na ito sa iba't ibang konsentrasyon.
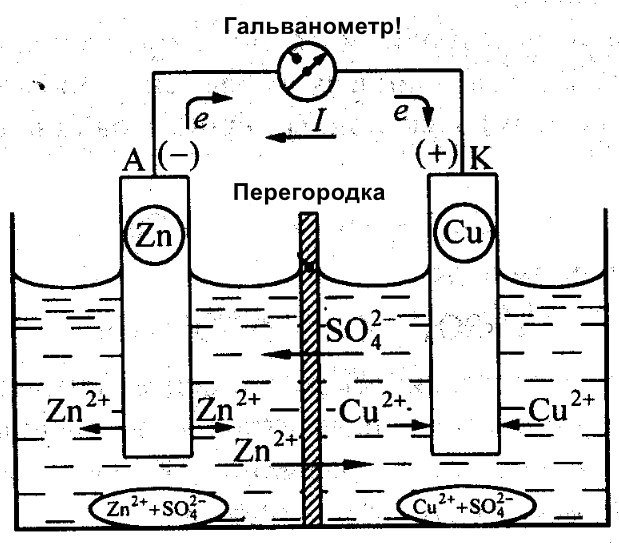
Bukod kay Galvani, nagtrabaho rin si Daniel Jacobi sa paglikha ng isang mahusay na baterya. Bahagyang binago niya ang kanyang pinagmumulan ng enerhiya. Binubuo ito ng isang platong tanso na nakalagay sa CuSO4 at isang platong zinc na nakalubog sa ZnSO4. Upang maiwasan ang direktang pag-uugnay ng mga ito, isang butas-butas na pader ang inilalagay sa pagitan nila. Nasa ibaba ang isang diagram ng galvanic cell ni Daniel Jacobi.
Magkaiba ang reaktibiti ng zinc at tanso, kaya naman magkakaiba ang kanilang karga. Dahil dito, hindi rin pare-pareho ang antas ng mga electrode. Dahil dito, nakakagalaw ang mga ito at nakakabuo ng kuryente o galvanic current. Nagsisimulang dumaloy ang kuryenteng ito kapag ang isang tao o ang imbentor ng current-storing device ay nagkonekta ng karga. Ang karga na ito ay maaaring bombilya, radyo, computer mouse, o iba pang mga de-kuryenteng aparato.
- Diagram ng eskematiko ng isang galvanic cell
- Ang istruktura ng isang galvanic cell
- Ang prinsipyo ng pagpapatakbo ng isang galvanic cell
- Mga sagot sa mga madalas itanong
- Mga uri ng galvanic cell
- Talahanayan ng mga selulang galvaniko
- Layunin ng isang galvanic cell
- Selulang galvaniko sa bahay
- Proseso ng paggawa
Diagram ng eskematiko ng isang galvanic cell
Ang isang circuit diagram ay tumutukoy sa komposisyon at istruktura nito. Maaari itong buuin mula sa ilang elementong kemikal gamit ang mga pantulong na aparato. Sa ibaba, ang istruktura ng isang galvanic cell ay maikling ilalarawan. Magbasa nang higit pa tungkol dito sa artikulong ito.!
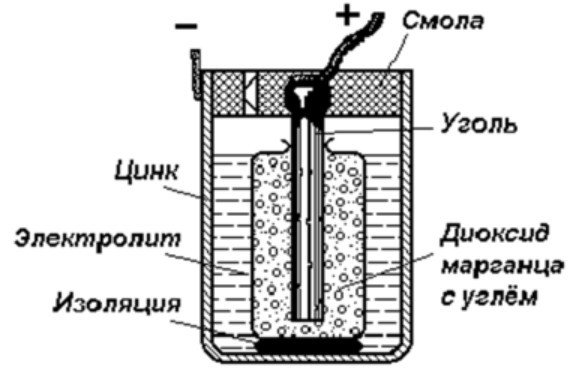
Ang istruktura ng isang galvanic cell
Ang pinakasimpleng aparato sa pag-iimbak ng enerhiya ay binubuo ng:
- Pamalo ng uling.
- Dalawang magkaibang metal.
- Elektrolito.
- Dagta o plastik.
- Isolator.
Gaya ng makikita sa diagram na ito, ang isang galvanic cell ay binubuo ng isang negatibo at isang positibong elektrod. Maaari itong gawa sa tanso, zinc, o iba pang mga metal. Tinatawag silang mga copper-zinc cell. Minsan ay tinatawag din silang mga tuyong baterya.
Pagtatalaga ng isang galvanic cell sa isang diagram Ito ay ginawa sa anyo ng dalawang patayong linya, malapit sa isa't isa sa isang maliit na distansya. Ang isa sa mga ito ay magiging mas maliit. Sa mga gilid ng bawat naturang linya ay may mga palatandaan na nagpapahiwatig polaridadAng mahabang linya ay minarkahan ng positibo, at ang maikling linya ay negatibo. Ang boltahe ay maaaring ipakita sa tabi nito. Nangangahulugan ito na ang circuit na gumagamit ng baterya ay gumagana lamang sa boltaheng iyon.
Ang prinsipyo ng pagpapatakbo ng isang galvanic cell
Ang isang galvanic cell ay gumagana sa pamamagitan ng paggalaw ng mga electron mula sa isang metal na dumikit patungo sa isa pa. Nagaganap ang isang kemikal na pagbabago. Magbasa nang higit pa tungkol sa termodinamika ng isang galvanic cell at ang pagbuo ng galvanic electricity. Dito.
Mga sagot sa mga madalas itanong
| Galbaniko | Paliwanag |
| Baterya | Isang pinagmumulan ng enerhiya na gumagana sa pamamagitan ng mga prosesong nagaganap sa loob ng isang maliit at nakakulong na espasyo. Sa partikular, ang enerhiya ay nalilikha sa pamamagitan ng isang reaksiyong kemikal. |
| Selulang Voltaic o tumpok na Voltaic | Ito ay isang elemento ng enerhiya na unang nilikha ng isang siyentipiko na nagngangalang Volt. |
| Proseso | Ang interaksyon sa pagitan ng mga elementong kemikal na nagreresulta sa pagbuo ng kuryente. |
| Paglabas | Ito ang pagkumpleto ng isang reaksiyong kemikal. Ibig sabihin, walang magiging interaksyon sa pagitan ng mga sangkap. May galvanic discharge sa Warframe. Sa esensya, ito ay isang pagbabago na kakaunti ang suplay. Ginagamit ito para sa mga melee weapon. PolaridadV2. |
| Kontak ng galvaniko | Ito ang kontak sa pagitan ng mga electrodes at ng solusyon. |
| Epekto | Ang anyo ng pagkakaiba sa pagitan ng dalawang kontak na gawa sa dalawang uri ng metal. Ang magnitude ay nakadepende sa temperatura at kemistri ng mga konduktor. Sa esensya, ito ang unang batas ni Volta. |
| Koneksyon/kawing/kadena | Pagkonekta ng dalawa o higit pang mga seksyon ng isang electrical circuit sa isang pinagmumulan ng kuryente. |
| Karga ng galvaniko | Pagpuno ng enerhiya sa baterya. |
Ang galvanisasyon ay isang prosesong kemikal na gumagamit ng kuryente. Binabawasan ng reaksyon ang dami ng natunaw na mga cation ng metal hanggang sa puntong bumubuo ang mga ito ng pare-parehong patong sa isang metal na elektrod. Bilang resulta, ang bagay ay nagiging mas matibay, nawawala ang maliliit na dents, at nagiging mas kaakit-akit ang hitsura nito.
Mga uri ng galvanic cell
Mayroong ilang mga partikular na uri ng mga baterya.
Talahanayan ng mga selulang galvaniko
| Uri | Boltahe | Pangunahing mga bentahe |
| Litium | 3 V | Malaki kapasidad, mataas na kuryente. |
| Mga baterya ng asin o carbon-zinc | 1.5 pulgada | Ang pinakamura. |
| Nikel oxyhydroxyl NiOOH | 1.6 volts | Mataas na kuryente. Mataas na kapasidad. |
| Alkalina o alkalina | 1.6 V | Mataas na kuryente. Maganda ang volume. |
Ang paksang ito ay tinalakay nang mas detalyado sa artikulo. mga uri ng baterya!
Layunin ng isang galvanic cell
Ito ay dinisenyo upang paandarin ang mga kagamitang elektrikal. Maaaring kabilang dito ang:
- Manood.
- Mga remote control.
- Mga flashlight.
- Mga kagamitang medikal.
- Mga laptop.
- Mga laruan.
- Mga Keychain.
- Mga telepono.
- Mga laser pointer.
- Mga calculator.
At mga katulad na bagay sa ating paligid.
Selulang galvaniko sa bahay
Maaari kang gumawa ng simpleng pinagmumulan ng kuryente nang mag-isa. Para magawa ito, kakailanganin mo ang mga sumusunod na kagamitan:
- Plastik na tasa.
- Elektrolito. Maaari itong maging solusyon sa asin, soda, o citric acid na hinaluan ng tubig.
- Mga plato na gawa sa dalawang magkaibang metal. Halimbawa, aluminyo at tanso.
- Mga Kable
Proseso ng paggawa
Kumuha ng plastik na tasa at ibuhos ang electrolyte dito. Huwag itong punuin hanggang sa labi; mainam na iwanan itong 1-2 sentimetro ang ikli. Ikabit ang mga alambre sa mga metal na plato. Susunod, ilagay ang mga tanso at aluminyo na plato sa mga gilid ng lalagyan. Dapat silang magkapantay. Kapag handa na ang lahat, maaari mong sukatin ang boltahe gamit ang isang voltmeter.
Ikonekta ang aparato at idikit ang mga probe sa mga contact ng ating pinagmumulan ng kuryente. Hawakan ang mga ito sa lugar hanggang sa ipakita ng display ang boltahe. Karaniwan, ito ay 0.5-0.7 volts. Ang mga halagang ito ay nakadepende sa electrolyte, o mas tumpak, sa sangkap na ginagamit bilang electrolyte.
Ganito ginagawa ang isang gawang-bahay na galvanic cell.